Kerendia har utvärderats i kliniska studier1
FIGARO-DKD-Studien
Kardiovaskulär dödlighet och sjukdom
(N=7437*)2
FIDELIO-DKD-studien
Terminal njursvikt, försämring av kronisk
njursjukdom, och njurrelaterad död
FIDELITY
Prespecificerad, poolad analys
(N=13,171†)1
Studieutformning för FIGARO-DKD och FIDELIO-DKD1
Båda studierna hade identisk design

*Om serumkalium var ≤ 4,8 mmol/L och eGFR var stabilt uppmuntrades patienter att öka sin dos från 10 till 20 mg en gång dagligen. Om serumkalium var > 4,8 mmol/L och/eller eGFR inte var stabilt kunde patienter minska sin dos från 20 till 10 mg en gang dagligen.1
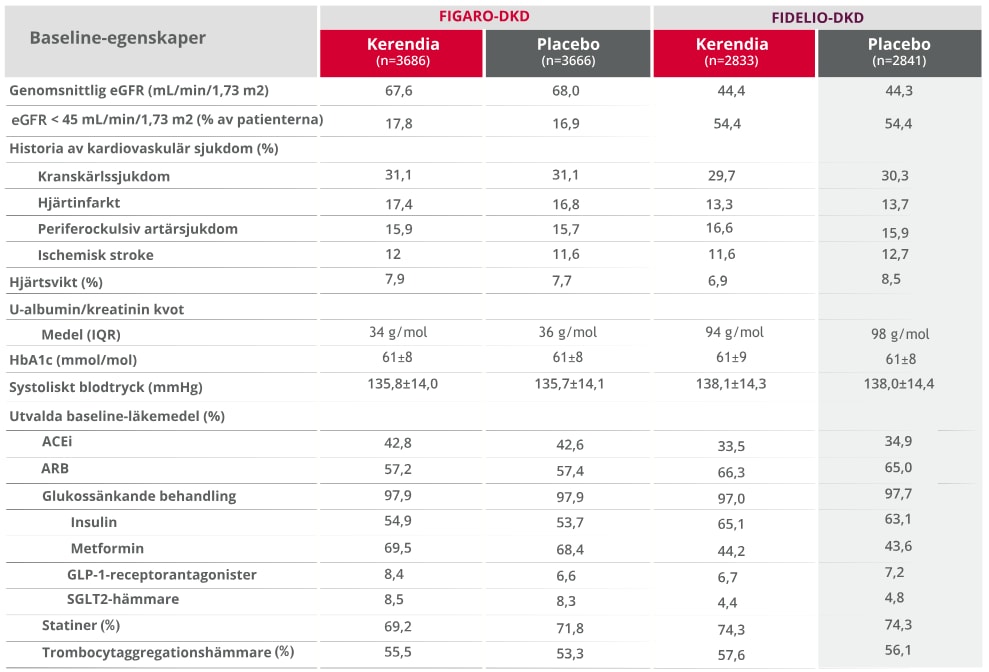
Patientkarakteristika var likartade mellan grupperna i båda prövningarna1,2
Utvalda inklusions- och exklusionskriterier2,3

*Dessa kriterier gäller endast FIDELIO-DKD-prövningen.
†Dessa kriterier gäller FIGARO-DKD-prövningen.
Kerendia utvärderades hos > 13 000 patienter med tidigt till sent stadium av CKD1*
99,8 % av patienterna behandlades med den maximala tolererade dosen av en ACEi eller ARB och 97,7 % behandlades med minst ett glukossänkande medel
FIGARO-DKD-STUDIEN
(INRIKTAD PÅ KARDIOVASKULÄR SJUKDOM)2
Primärt sammansatt effektmått:
- Kardiovaskulär död
- Icke-dödlig hjärtinfarkt
- Icke-dödlig stroke
- Inläggning på sjukhus för hjärtsvikt
FIDELIO-DKD-STUDIEN
(INRIKTAD PÅ NJURSJUKDOM)3
Primärt sammansatt effektmått:
- Njursvikt (Dialys, transplantation, eGFR<15 mL/min/1,73m2)
- Långvarig minskning ≥ 40 % av eGFR
- Njurdöd

FIDELIO-DKD- prövningen
Kerendia ledde till minskning av U-ACR från baslinjen efter 4 månader3

Geometriskt medelvärde för UACR vid baslinjen ± geometrisk SD:
Kerendia: 798,79 ± 2,65
Placebo: 814,73 ± 2,67
Utöver standardbehandling
Vid 4 månader
31%
(95% CI:
0,66-0,71)
Enligt ADA:s standardbehandling 2022 rekommenderas:
Minskning av urinalbumin med ≥ 30 % hos patienter med CKD som har U-ACR ≥ (30 g/mol) för att minska CKD-progressionen.4
Kerendia minskar progressionen för kronisk njursjukdom signifikant3
Effekten drevs primärt av delmåttet sjukhusinläggning för hjärtsvikt reference3

Primärt effektmått vid 36 månader
18% RRR
HR=0.82
(95% CI:
0,73-0,93)
P=0,001
3,4% ARR
(95% CI: 0,6-6,2)
NNT: 29
(95% CI: 16-166)
FIGARO-DKD- prövningen
Kerendia minskade signifikant risken för kardiovaskulära händelser2

Primärt effektmått vid 36 månadera
13% RRR
HR=0,87
(95% CI:
0,76-0,98)
P=0,03
2.1% ARR
(95% CI: 0,4-3,8)
NNT: 47
(95% CI: 26-226)
aKardiovaskulärt utfallsmått; sammansättning av tid till första uppkomst av kardiovaskulär död, icke-fatal hjärtinfarkt, icke-fatal stroke, sjukhusinläggning för hjärtsvikt HR 0,87 (95% CI 0,76 - 0,98) 13% RRR, 2,1% ARR (95% CI 0,4 - 3,5) (efter 3,5 år). Effekten drevs primärt av delmåttet sjukhusinläggning för hjärtsvikt.3

Prespecificerad, poolad analys
Säkerhetsprofilen för Kerendia baseras på data för > 13 000 patienter1
0,1% (8) vs 0,2% (11)
5,6% (362) vs 5,6% (361)
0% vs <0,1% (5)
Lägg till Kerendia till din standardbehandling5
† Patienter randomiserade.1-3
*2,4% av patienterna hade baslinje eGFR <25 mL/min/1,73 m2 i FIDELIO-DKD studien och 0,4% i FIGARO-DKD-studien. 0,4% av patienterna hade baslinje UACR <3 g/mol i FIDELIO-DKD studien och 2,8% i FIGARO-DKD-studien. 2,3
**Publicerade data konverterade från mg/g till g/mol.
ACEi = angiotensinkonverterande enzymhämmare; ARB = angiotensinreceptorblockerare; eGFR = uppskattad glomerulär filtrationshastighet; U-ACR = kreatininrelaterat urinalbumin; CVD = kardiovaskulär sjukdom; GLP-1 = glukagonliknande peptid 1; IQR = interkvartilomfång; MI = hjärtinfarkt; SGLT2 = natrium-glukos-kotransportör 2.
Referenser:
- Agarwal R, et al. Eur Heart J. 2022;43(6):474-484. doi:10.1093/eurheartj/ehab777 Return to content
- Pitt B, et al. N Engl J Med. 2021;385(24):2252-2263. Return to content
- Bakris GL, et al; FIDELIO-DKD Investigators. N Engl J Med. 2020;383(23):2219-2229. doi:10.1056/NEJMoa2025. Return to content
- American Diabetes Association® Professional Practice Committee; Draznin B, et al. Diabetes Care. 2022;45(suppl 1):S175-S184. Return to content
- Kerendia SPC Feb 2023 Return to content
Kerendia (finerenon) är en ickesteroid, selektiv mineralkortikoidreceptorantagonist. ATC kod C03DA05, tabletter 10 mg, 20 mg Rx (F). Indikation: Kerendia är avsett för behandling av kronisk njursjukdom (med albuminuri) associerad med typ 2-diabetes hos vuxna. För studieresultat avseende renala och kardiovaskulära händelser, se avsnitt 5.1 i SPC. Subventioneras endast för behandling av kronisk njursjukdom (med albuminuri) associerad med typ 2-diabetes hos vuxna. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Samtidig behandling med starka hämmare av CYP3A4. Addisons sjukdom. Varningar och försiktighet: Hyperkalemi har observerats hos patienter behandlade med finerenon. Vissa patienter löper högre risk att utveckla hyperkalemi. Riskfaktorer inkluderar lågt eGFR, högt serumkalium och tidigare episoder av hyperkalemi. Hos dessa patienter ska tätare kontroller övervägas. Om serumkalium är > 5,0 mmol/l ska behandling med finerenon inte initieras. Om serumkalium är > 4,8 till 5,0 mmol/l kan initering av behandling med finerenon övervägas med ytterligare kontroller av serumkalium under de första 4 veckorna baserat på patientegenskaper och serumkaliumnivåer. Om serumkalium är > 5,5 mmol/l ska behandling med finerenon avbrytas. Risken för hyperkalemi kan också öka vid samtidig användning av läkemedel som kan öka serumkaliumnivåer. Behandling med finerenon ska inte initieras hos patienter med gravt nedsatt leverfunktion, eller vid gravt nedsatt njurfunktion (eGFR < 25 ml/min/1,73 m2). Användning vid graviditet och amning bör ej ske.
Datum för senaste översynen av produktresumén feb 2023. Bayer AB. Box 606. 169 26 Solna. Tel. 08-580 223 00. För ytterligare information, pris samt före förskrivning vänligen läs produktresumé på www.fass.se
▼ Detta läkemedel är föremål för utökad övervakning. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket. MA-M_FIN-SE-0018-5

