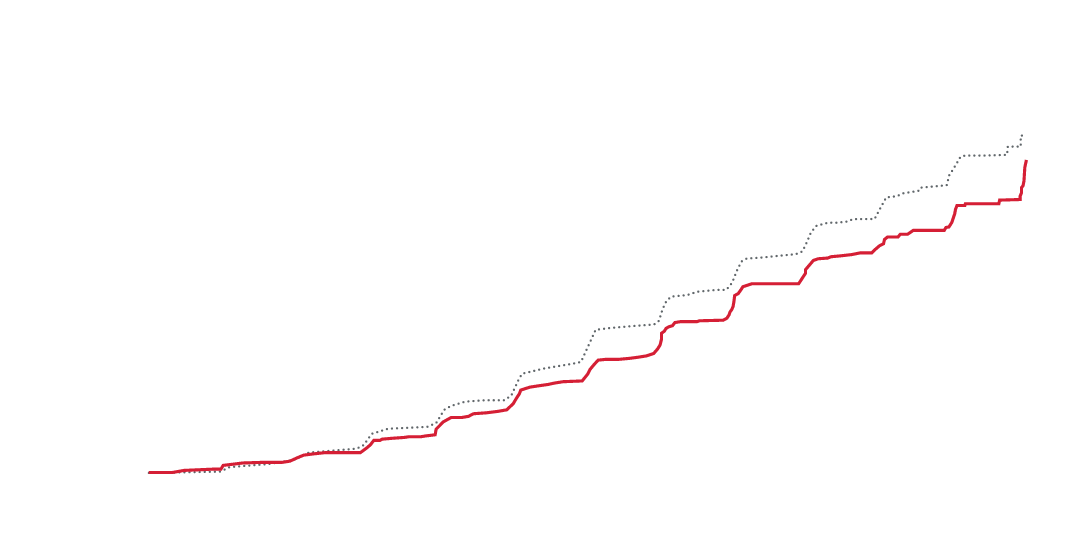
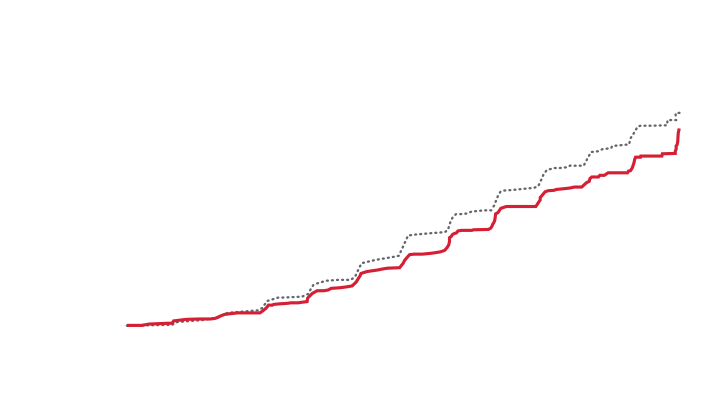
Primärt effektmått
Kerendia minskade signifikant progressionen av kronisk njursjukdom jämfört med placebo1
Number of patients at risk
18 % RRR1
HR = 0,82
(95 % CI: 0,73-0,93)
P = 0,0014
Sänker den kombinerade risken för1:
- Tid till första förekomst av njursvikt*
- En långvarig minskning av eGFR på ≥ 40 % jämfört med värdet vid baseline under ≥ 4 veckor
- Njurrelaterade dödsfall
3,4 % ARR
(95 % CI: 0,6-6,2)2
NNT: 29
(95 % CI: 16–166) för att förhindra en primär effektmåttshändelse2
Skillnader utöver standardbehandling1
- Maximalt tolererad dos av ACEi/ARB
- 97 % av patienterna använde ≥ 1 antidiabetesbehandling(ar) vid baseline
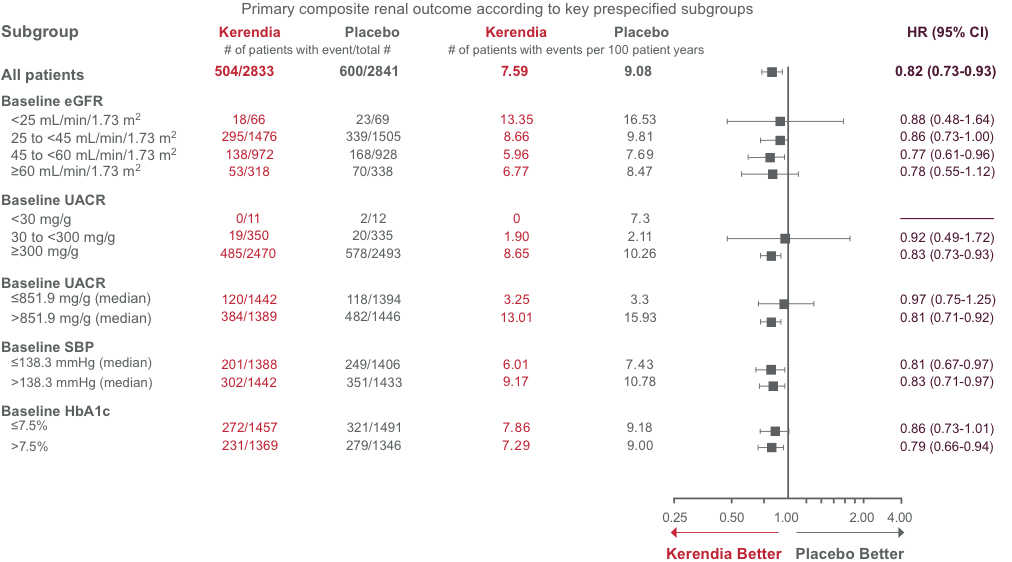
Den minskade risken för progression av kronisk njursjukdom var i allmänhet konsistent med Kerendia3
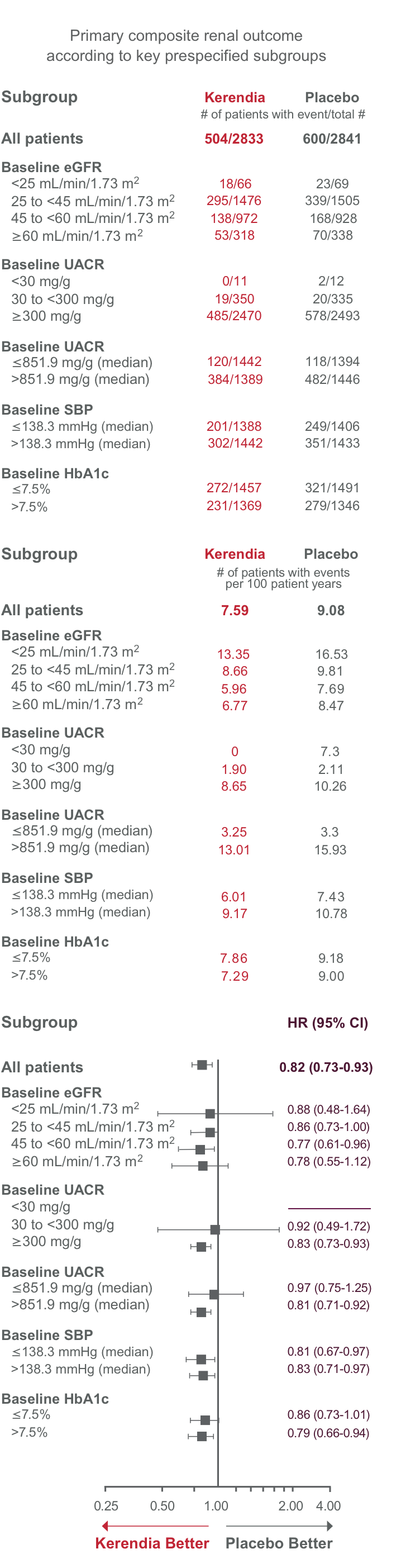
Kerendia förknippades med en minskning på 31 % i genomsnittlig grad av U-ACR från baseline till månad 41,3
Antal forskningspersoner vid besöket
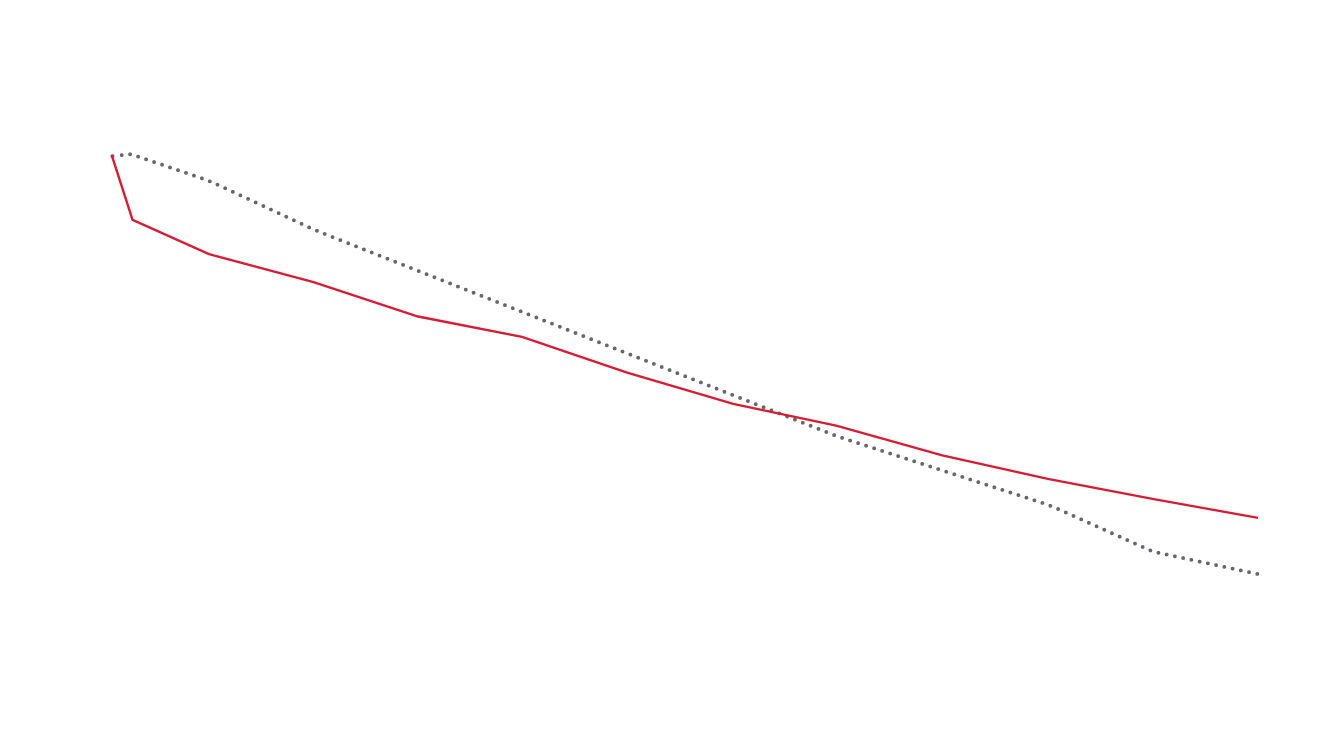
Patienter på Kerendia upplevde en initial minskning av eGFR (medelvärde 2 ml/min/1,73 m2) som försvagades med tiden jämfört med placebo1
Genomsnittlig förändring av eGFR (ml/min/1,73 m² [95 % CI])2†
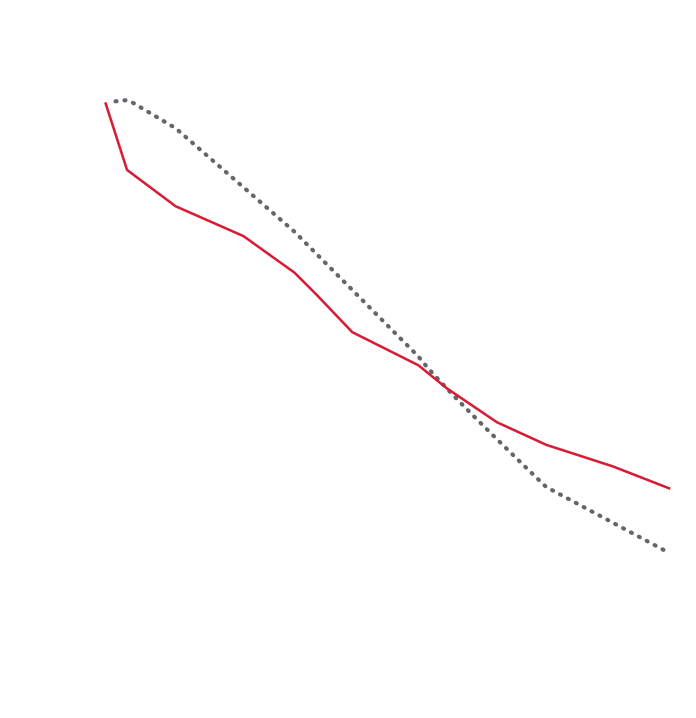
Genomsnittlig förändring från baseline till månad 4:
Kerendia: -3,18 (-3,44 to -2,91)
Placebo: -0,73 (-1,03 to -0,44)
Genomsnittlig förändring från månad 4 till permanent utsättning eller avslutad studie:
Kerendia: -2,66 (-2,96 to -2,36)
Placebo: -3,97 (-4,27 to -3,66)
Genomsnitt eGFR vid baseline ± SD:
Kerendia: 44,4 ± 12,5
Placebo: 44,3 ± 12,6
* Njursvikt definierades som kronisk dialys eller njurtransplantation, eller en långvarig minskning av eGFR till < 15 ml/min/1,73 m2 över ≥ 4 veckor.1
† Genomsnittlig förändring enligt minsta kvadratmetoden från baseline i hela analysuppsättningen.2
ACEi = angiotensinkonverterande enzymhämmare; ARB = angiotensinreceptorblockerare; ARR = absolut riskreduktion; CI = konfidensintervall; CKD = kronisk njursjukdom; CV = kardiovaskulär; eGFR = uppskattad glomerulär filtrationshastighet; HbA1c = glykosylerat hemoglobin; HR = riskkvot; MI = hjärtinfarkt; NNT = antal som behövde behandlas; RRR = relativ riskreduktion; SBP = systoliskt blodtryck; SD = standardavvikelse; U-ACR = kreatininrelaterat urinalbumin.
Referenser:
- Kerendia SPC Feb 2023 Return to content
- Supplementary Appendix to: Bakris GL, et al. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. NEJM 2020;383:2219-29. DOI: 10.1056/NEJMoa2025845 Return to content
- Bakris GL, et al; FIDELIO-DKD Investigators. N Engl J Med. 2020;383(23):2219-2229. Return to content
- Filippatos G, et al. Circulation. 2021;143(6):540-552. Return to content
Kerendia (finerenon) är en ickesteroid, selektiv mineralkortikoidreceptorantagonist. ATC kod C03DA05, tabletter 10 mg, 20 mg Rx (F). Indikation: Kerendia är avsett för behandling av kronisk njursjukdom (med albuminuri) associerad med typ 2-diabetes hos vuxna. För studieresultat avseende renala och kardiovaskulära händelser, se avsnitt 5.1 i SPC. Subventioneras endast för behandling av kronisk njursjukdom (med albuminuri) associerad med typ 2-diabetes hos vuxna. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Samtidig behandling med starka hämmare av CYP3A4. Addisons sjukdom. Varningar och försiktighet: Hyperkalemi har observerats hos patienter behandlade med finerenon. Vissa patienter löper högre risk att utveckla hyperkalemi. Riskfaktorer inkluderar lågt eGFR, högt serumkalium och tidigare episoder av hyperkalemi. Hos dessa patienter ska tätare kontroller övervägas. Om serumkalium är > 5,0 mmol/l ska behandling med finerenon inte initieras. Om serumkalium är > 4,8 till 5,0 mmol/l kan initering av behandling med finerenon övervägas med ytterligare kontroller av serumkalium under de första 4 veckorna baserat på patientegenskaper och serumkaliumnivåer. Om serumkalium är > 5,5 mmol/l ska behandling med finerenon avbrytas. Risken för hyperkalemi kan också öka vid samtidig användning av läkemedel som kan öka serumkaliumnivåer. Behandling med finerenon ska inte initieras hos patienter med gravt nedsatt leverfunktion, eller vid gravt nedsatt njurfunktion (eGFR < 25 ml/min/1,73 m2). Användning vid graviditet och amning bör ej ske.
Datum för senaste översynen av produktresumén feb 2023. Bayer AB. Box 606. 169 26 Solna. Tel. 08-580 223 00. För ytterligare information, pris samt före förskrivning vänligen läs produktresumé på www.fass.se
▼ Detta läkemedel är föremål för utökad övervakning. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket. MA-M_FIN-SE-0018-5