För vuxna patienter med kronisk njursjukdom (CKD) och typ 2-diabetes
Kerendia säkerhetsprofil1
- Behandlingsavbrott på grund av eventuella biverkningar var 7,3 % för Kerendia och 5,9 % för placebo1
- Regelbunden monitorering av serumkalium rekommenderas2
Hormonella symtom med Kerendia var jämförbara med placebo1
- Gynekomasti: 0,2 % för Kerendia, 0,2 % för placebo
- Bröstrubbning: < 0,1 % för Kerendia, 0 % för placebo
- Brösthyperplasi: 0 % för Kerendia, 0,1 % för placebo
Kerendias effekt på SBP och på HbA1C över tid1-3*
Genomsnittligt SBP över tid1,2
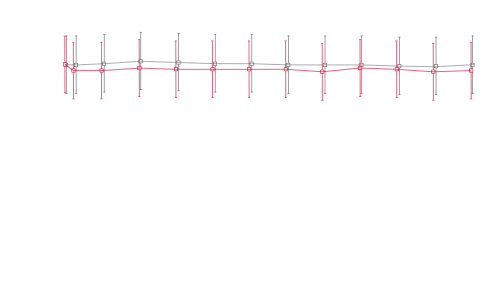
Genomsnittligt SBP vid baseline ± SD
Kerendia: 138,02 ± 14,31
Placebo: 137,98 ± 14,42
Genomsnittligt HbA1c över tid2

Genomsnittligt HbA1c vid baseline ± SD:
Kerendia: 7,66 ± 1,33
Placebo: 7,69 ± 1,36
* Den genomsnittliga minskningen av SBP från baseline till månad 4 var 3,2 mmHg.
De vanligaste rapporterade biverkningarna1,3
† Dessa händelser klassificerades enligt MedDRA:s föredragna term.3
‡ Dessa händelser klassificerades enligt den standardiserade MedDRA Query-termen.3
Kerendias inverkan på serumkalium2
Maximal genomsnittlig skillnad i kalium mellan grupperna var 0,23 mmol/l (SD ± 0,5) månad 4 och förblev därefter stabil1
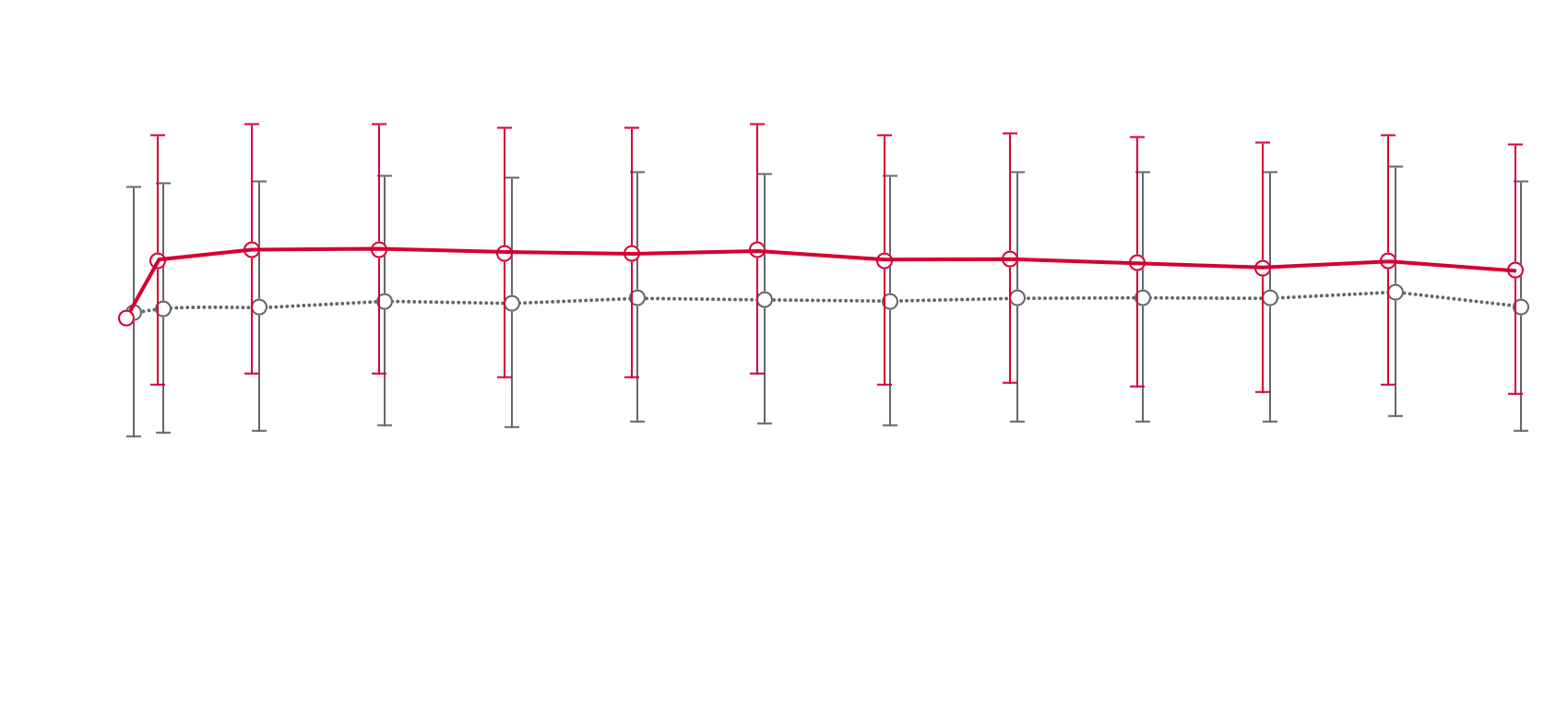
Kerendias inverkan på hyperkalemi1-3§
§Trots att hyperkalemi ökade i Kerendia-gruppen var hyperkalemi hanterbart medan kliniskt meningsfulla händelser som utsättning av studieläkemedel, sjukhusinläggning och allvarliga biverkningar var låga.1-3
||De biverkningar som visas här är biverkningar som inträffade under behandlingsperioden och definieras som de som uppträdde eller förvärrades under intag av Kerendia eller placebo eller upp till tre dagar efter ett tillfälligt eller permanent avbrott. Ett orsakssamband mellan biverkningar och administrering av Kerendia eller placebo baserades på den rapporterande utredarens uppfattning.3
¶Rapporterade av utredare med användning av MedDRA:s föredragna termer ”hyperkalemi” och ”förhöjt blodkalium.”3
#En biverkning ansågs vara allvarlig om den ledde till dödsfall, var livshotande, ledde till sjukhusvistelse (eller förlängd befintlig sjukhusvistelse), orsakade ihållande eller kliniskt signifikant funktionsnedsättning eller oförmåga, var en medfödd abnormitet eller fosterskada, eller som av utredaren bedömdes vara en allvarlig eller viktig medicinsk händelse.3
AE = biverkningar; CKD = kronisk njursjukdom; HbA1c = glykosylerat hemoglobin; MedDRA = Medical Dictionary for Regulatory Activities; SBP = systoliskt blodtryck; SD = standardavvikelse; T2D = typ 2-diabetes.
Referenser:
- Supplementary Appendix to: Bakris GL, et al. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. NEJM 2020;383:2219-29. DOI: 10.1056/NEJMoa2025845. Return to content
- Kerendia SPC Feb 2023 Return to content
- Bakris GL, et al; FIDELIO-DKD Investigators. N Engl J Med. 2020;383(23):2219-2229. Return to content
Kerendia (finerenon) är en ickesteroid, selektiv mineralkortikoidreceptorantagonist. ATC kod C03DA05, tabletter 10 mg, 20 mg Rx (F). Indikation: Kerendia är avsett för behandling av kronisk njursjukdom (med albuminuri) associerad med typ 2-diabetes hos vuxna. För studieresultat avseende renala och kardiovaskulära händelser, se avsnitt 5.1 i SPC. Subventioneras endast för behandling av kronisk njursjukdom (med albuminuri) associerad med typ 2-diabetes hos vuxna. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Samtidig behandling med starka hämmare av CYP3A4. Addisons sjukdom. Varningar och försiktighet: Hyperkalemi har observerats hos patienter behandlade med finerenon. Vissa patienter löper högre risk att utveckla hyperkalemi. Riskfaktorer inkluderar lågt eGFR, högt serumkalium och tidigare episoder av hyperkalemi. Hos dessa patienter ska tätare kontroller övervägas. Om serumkalium är > 5,0 mmol/l ska behandling med finerenon inte initieras. Om serumkalium är > 4,8 till 5,0 mmol/l kan initering av behandling med finerenon övervägas med ytterligare kontroller av serumkalium under de första 4 veckorna baserat på patientegenskaper och serumkaliumnivåer. Om serumkalium är > 5,5 mmol/l ska behandling med finerenon avbrytas. Risken för hyperkalemi kan också öka vid samtidig användning av läkemedel som kan öka serumkaliumnivåer. Behandling med finerenon ska inte initieras hos patienter med gravt nedsatt leverfunktion, eller vid gravt nedsatt njurfunktion (eGFR < 25 ml/min/1,73 m2). Användning vid graviditet och amning bör ej ske.
Datum för senaste översynen av produktresumén feb 2023. Bayer AB. Box 606. 169 26 Solna. Tel. 08-580 223 00. För ytterligare information, pris samt före förskrivning vänligen läs produktresumé på www.fass.se
▼ Detta läkemedel är föremål för utökad övervakning. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket. MA-M_FIN-SE-0018-5

