Xofigo® - den första och enda riktade alfaterapin
Mer än 10 års erfarenhet inom mCRPC
Xofigo® (radium 223) är indicerat för
- Monoterapi eller behandling i kombination med gonadotropinfrisättande hormon (GnRH) analog hos vuxna med metastaserad kastrationsresistent prostatacancer (mCRPC) med symtomatiska benmetastaser och inga kända viscerala metastaser vid sjukdomsprogression efter minst 2 tidigare linjer av systemisk behandling av mCRPC (förutom GnRH- analoger), eller
- när annan tillgänglig systemisk mCRPC-behandling är olämplig.1
Ladda ner behandlingsguide
Xofigo® pocket treatment guide (PDF)
ALSYMPCA-studien dokumenterar effekten av Xofigo®
ALSYMPCA-studien stöder och bekräftar att tidig behandling med Xofigo hos patienter med mCRPC är fördelaktig innan viscerala metastaser utvecklas:1-2
Förlängd total överlevnad
- 30 % minskning av risken för död jämfört med placebo1,2
3,6 månader längre överlevnad med Xofigo (HR = 0,70; 95% CI, 0,55-0,88; P<0,01)
Säkerhetsprofil
- Biverkningar av grad 3-4 är jämförbara med placebo2
- Kemoterapi efter behandling med Xofigo tolererades väl jämfört med kemoterapi efter placebobehandling.4
Se de vanligaste biverkningarna och försiktighetsåtgärderna i FASS.
Förlängd tid till minskad livskvalitet under behandling
- FACT-P totalpoäng: -3,880 vs -7,651, p = 0,0062
Rekommenderat behandlingsfönster med Xofigo®
Xofigo® är ett behandlingsalternativ för vuxna patienter med kastrationsresistent prostatacancer med symtomatiska benmetastaser och inga kända viscerala metastaser.
Vid progression av benmetastaser är det viktigt att överväga Xofigo® innan viscerala metastaser utvecklas. 1 Se rekommenderat behandlingsfönster:
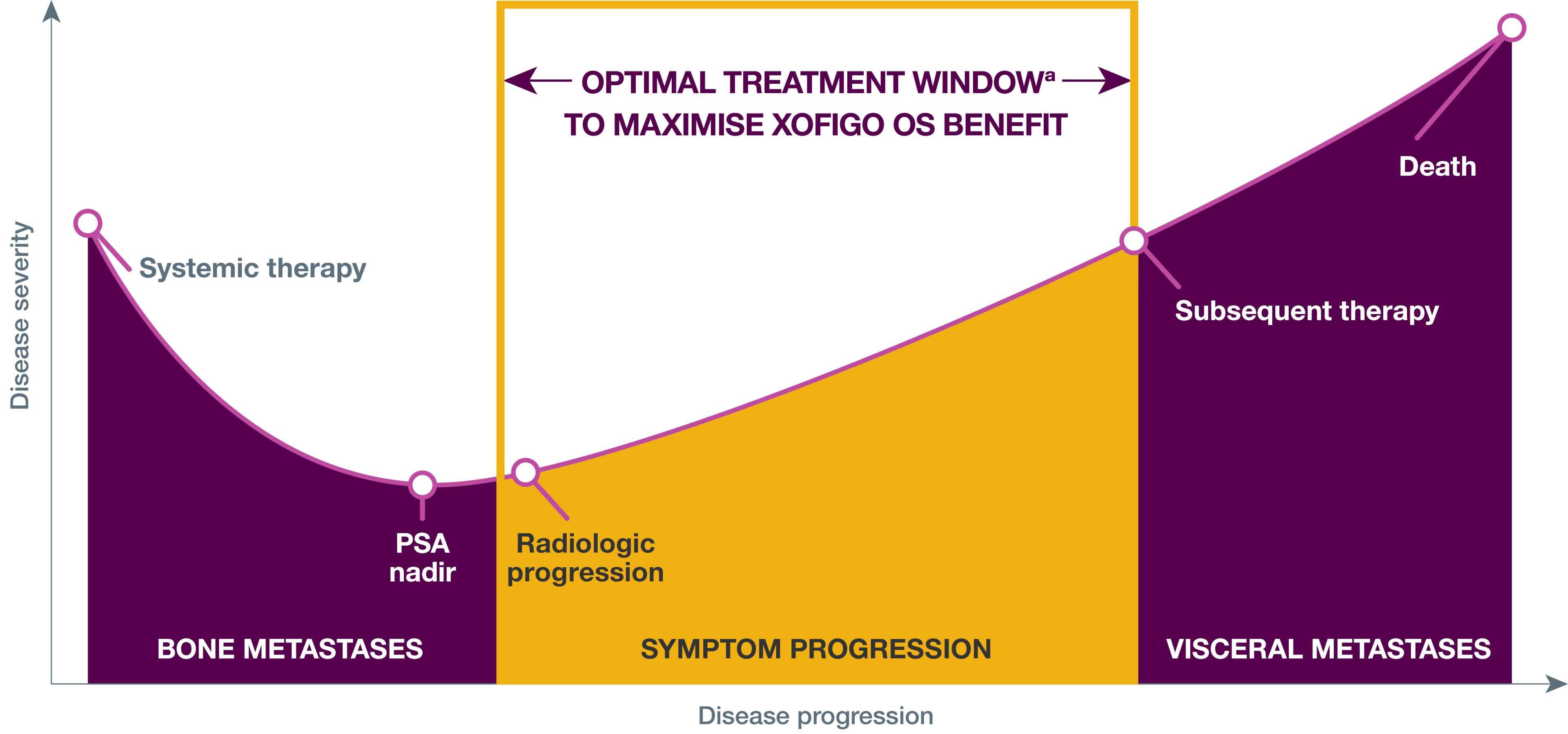
Behandlingssekvensering för mCRPC: Resultat från observationsstudie5
Även om både Xofigo och 177-Lutetium-PSMA är godkända behandlingar för mCRPC, har säkerheten och effekten av specifika sekventiella behandlingsförlopp inte tidigare omfattande undersökts. 5
RaLu-studien har visat att klinisk administrering av Xofigo följt av 177-Lutetium-PSMA-terapi är lämpligt för patienter med mCRPC som tidigare har genomgått flera behandlingsformer. Det är viktigt att notera att denna studie inte visar några tecken på att säkerheten eller effektiviteten av 177-Lutetium-PSMA försämras efter användning av Xofigo. 5
Förlängd total överlevnad
- 33,4 månaders median total överlevnad med XOFIGO följt av 177-Lutetium-PSMA .5a
Säkerhetsprofil
- Kliniskt genomförbart och väl tolererat att använda 177-Lutetium-PSMA efter XOFIGO.5b
a. 95 % KI, 31,2-37,4. b. De vanligaste biverkningarna av särskilt intresse (alla grader) hos ≥10 % av patienterna: torr mun 20/133 (15 %), illamående 12/133 (9 %) och trötthet 11/113 (8 %). Grad 3-4 av biverkningar inträffade hos 37/133 patienter (28 %). De vanligaste var anemi och trombocytopeni.
Dosering av Xofigo®
Xofigo® ges som en 1- minuters injektion en gång var 4:e vecka i 6 månader1
Effekten av avslutad Xofigo-behandling på totalöverlevnad hos mCRPC-patienter med benspridning6
I en retrospektiv RWE observationsstudie följdes mCRPC-patienter med symptomatiska benmetastaser. Studien visade att patienter som genomförde alla 6 behandlingscykler uppnådde större totalöverlevnadsfördelar från Xofigo-behandlingen jämfört med de som fick färre än 6 cykler.6
Studien genomfördes som en retrospektiv analys baserad på epidemiologiska data från fem medicinska center under en femårsperiod. Syftet var att fastställa om sex avslutade behandlingscykler med Xofigo gav bättre fördelar jämfört med att få färre än 6 cykler.6
Förlängd totalöverlevnad6
• Median totalöverlevnad: 15 månader (n=187)
• Signifikant längre median totalöverlevnad för de som fick alla 6 Xofigo-doser (31 månader jämfört med 6 månader för de med <6 doser) (p=0,001)
1 års medianöverlevnad efter första Xofigo dos:
• 87% för patienter som genomgått alla 6 behandlingsdoser (n=94/107)
• 30 % för patienter med <6 fullbordade behandingsdoser (n=24/80)
RWE: real world evidence
Xofigos verkningsmekanism
Xofigo är ett terapeutiskt alfastrålande läkemedel.
Xofigo Manufacturing in Oslo
Bayer har etablerat en unik och dedikerad produktionsanläggning för XOFIGO i Oslo - en säker och pålitlig helhetsleveranskedja för att nå patienter i rätt tid över hela världen.
Referens
- Xofigo® SPC 09/2023 Return to content
- Parker C, Nilsson S, Heinrich D, et al. Alpha emitter radium- 223 and survival in metastatic prostate cancer. N Engl J Med. 2013;369(3):213-223 Return to content
- Fizazi K, Shore N, Tammela TL, et al. Nonmetastatic, castration-resistant prostate cancer and survival with darolutamide. N Engl J Med. 2020;383(11):1040–1049. Return to content
- Sartor, Oliver et al. Chemotherapy following radium-223 dichloride treatment in ALSYMPCA. The Prostate vol. 76,10 (2016);905-16. Return to content
- Rahbar K, Essler M, Eiber M, et al. 17 7Lu-Prostate-Specific Membrane Antigen Therapy in Patients with Metastatic Castration-Resistant Prostate Cancer and Prior 22 3Ra (RALU Study). J Nucl Med. Oct 2023, jnumed.12 3.266125; DOI: https://doi.org/10.2967/jnumed.123.266125. Return to content
- Buscombe J, Gillett D, Bird N, et al. Quantifying the survival benefit of completing all the six cycles of radium‑223 therapy in patients with castrate‑resistant prostate cancer with predominant bone metastases. World J Nucl Med 2021; 20(02): 139 -144 DOI: 10.4103/wjnm.WJNM_74 _20. Return to content
Se Xofigo® SPC här
Xofigo® (radium Ra-223-diklorid) 1 100 kBq/ml injektionsvätska, lösning. För intravenös användning. Rx, EF, V10XX03.
Indikation: Xofigo i monoterapi eller i kombination med gonadotropinfrisättande hormon (GnRH)-analog, är avsett för behandling av vuxna patienter med metastaserande kastrationsresistent prostatacancer, (mCRPC), med symtomatiska skelettmetastaser och inga kända viscerala metastaser, med progress efter minst två tidigare behandlingar med systemisk terapi mot mCRPC (andra än GnRH-analoger), eller då behandling med tillgänglig systemisk mCRPC-behandling är
olämplig.
Farmakoterapeutisk grupp: V10XX03, radiofarmaceutiska terapeutika,
diverse.
Kontraindikationer: Xofigo är kontraindicerat i kombination med abirateronacetat och prednison/prednisolon.
Varningar och försiktighet: Säkerhet och effekt av Xofigo i kombination med cancerterapier andra än GnRH-analoger har inte fastställts; en ökad risk för mortalitet och frakturer är möjlig. Radium-223 i kombination med andra systemiska cancerterapier än GnRH-analoger rekommenderas därför inte. En ökad incidens av frakturer och dödsfall har observerats hos patienter som behandlats med Xofigo i kombination med abirateronacetat och prednison/prednisolon.
Behandlingsnyttan med Xofigo hos vuxna med kastrationsresistent prostatacancer och endast asymtomatiska skelettmetastaser har inte fastställts. Användning av Xofigo rekommenderas därför inte för behandling av vuxna med kastrationsresistent prostatacancer och endast asymtomatiska skelettmetastaser. Hos vuxna med kastrationsresistent prostatacancer och lindrigt symtomatiska skelettmetastaser ska nyttan med behandlingen vägas noga mot riskerna med hänsyn till att hög osteoblastisk aktivitet sannolikt krävs för att uppnå behandlingsnytta. Radium-223 rekommenderas inte till patienter med en låg nivå av osteoblastiska skelettmetastaser.
Innan behandling med Radium-223 inleds ska skelettstatus och frakturrisk noggrant bedömas och följas minst 24 månader.
Xofigo kan leda till benmärgssuppression med trombocytopeni och neutropeni varför blodstatus måste kontrolleras före behandling. Radiofarmaka ska endast tas emot, användas och administreras av behörig personal i ändamålsenliga lokaler. Administrering av radiofarmaka kan utgöra en risk för andra personer på grund av extern strålning eller kontamination från spill av urin, feces, uppkastningar. Med tanke på de potentiella effekter på spermatogenesen som är förknippade med strålning, bör män rådas att använda effektiva preventivmetoder under och upp till 6 månader efter behandling med Xofigo.
Biverkningar: (≥ 1/10) Diarré, illamående, kräkningar, trombocytopeni,
skelettfraktur. (≥ 1/100 < 1/10) neutropeni, pancytopeni, leukokpeni,
reaktion vid injektionsstället. (≥ 1/1 000 < 1/100) lymfopeni, osteoporos .
Kontaktuppgifter: Bayer AB, Box 606, 169 26 Solna, tel: 08-580 223 00.
Datum för senaste översyn av SPC: September 2023. För mer information,
samt före förskrivning, vänligen läs produktresumé på fass.se
▼ Detta läkemedel är föremål för utökad övervakning. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket.
MA-M_RAD-SE-0008-1_September 2023
NUBEQA® (darolutamid) 300 mg filmdragerade tabletter. ATC-kod: L02BB06 Rx,(F).
Indikation: NUBEQA är en androgenreceptorhämmare indicerad för behandling av 1) vuxna män med icke-metastaserad kastrationsresistent prostatacancer (nmCRPC) som löper hög risk för att utveckla metastaserad sjukdom, och 2) behandling av vuxna män med metastaserad hormonkänslig prostatacancer (mHSPC) i kombination med docetaxel och androgendeprivationsterapi (ADT).
Subventioneras endast för indikation 1 samt med begränsning för indikation 2 till när behandling med
abirateron inte är lämplig.
Kontraindikation: Överkänslighet mot den aktiva substansen eller något hjälpämne (laktos). Kvinnor som är eller kan bli gravida.
Varningar: Androgen deprivationsterapi kan förlänga QT intervallet. Män ska använda en mycket effektiv preventivmetod under behandlingen samt en vecka efter avslutad behandling. Vid avvikande leverfunktionstest som tyder på idiosynkratisk läkemedelsinducerad leverskada, avbryts behandlingen med darolutamid permanent.
Biverkningar: För nmCRPC indikationen observerades; (≥ 1/10) trötthet, minskat antal neutrofiler samt ökad mängd bilirubin och ASAT. Andra viktiga biverkningar (≥ 1/100, < 1/10) innefattar ischemisk hjärtsjukdom, hjärtsvikt, utslag, smärta och frakturer.
För mHSPC indikationen i kombination med docetaxel observerades; (≥ 1/10) hypertoni, utslag, minskat antal neutrofiler samt ökad mängd bilirubin, ASAT och ALAT. Andra viktiga biverkningar (≥ 1/100, < 1/10) innefattar frakturer och gynekomasti.
Datum för senaste översyn av SPC: 05/2024. För ytterligare information, pris samt före förskrivning vänligen läs produktresumé på fass.se.
Kontaktuppgifter: Bayer AB, Box 606, 169 26 Solna, tel: 08- 580 223 00
▼ Detta läkemedel är föremål för utökad övervakning. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket.
MA-M_DAR-SE-0034-1 Maj 2024


